核糖体
Template:Refimprove Template:NoteTA Template:主要细胞器
核糖体(ribosome),旧称“核糖核蛋白体”或“核蛋白体”,是细胞中的一种细胞器[1][注 1],它也是一種非膜狀特殊構造,由一大一小两个-{zh-tw:次單元;zh-cn:亚基}-结合形成[2],主要成分是相互缠绕的RNA(称为“核糖体RNA”,ribosomal RNA,简称“rRNA”)和蛋白质(称为“核糖体蛋白质”,ribosomal protein,简称“RP”)。核糖体是细胞内蛋白质合成的场所,能读取信使RNA核苷酸序列所包含的遗传信息,并使之转化为蛋白质中氨基酸的序列信息以合成蛋白质[3]。在原核生物及真核生物(地球上的两种具有细胞结构的主要生命形式,前者可细分为古菌、真细菌两类)的细胞中都有核糖体存在。一般而言,原核细胞只有一种核糖体,而真核细胞具有两种核糖体(线粒体和叶绿体中的核糖体与细胞质核糖体不相同)。
核糖体在细胞中负责完成“中心法则”裡由RNA到蛋白质这一过程[4],此过程在生物学中被称为“翻译”。在进行翻译前,核糖体小次單元会先与从细胞核中转录得到的信使RNA(messenger RNA,简称“mRNA”)结合,再结合核糖体大次單元构成完整的核糖体之后,便可以利用细胞质基质中的转运RNA(transfer RNA,简称“tRNA”)运送的氨基酸分子合成多肽[5]。当核糖体完成对一条mRNA单链的翻译后,大小-{zh-tw:次單元;zh-cn:亚基}-会再次分离。
英语中的“核糖体”(ribosome)一词是由“核糖核酸”(“ribo”)和希腊语词根“soma”(意为“体”)组合而成的。
概述

古菌、真细菌的细胞质中以及真核细胞的细胞质基质、线粒体和叶绿体中都含有核糖体,但它们各自拥有的核糖体在大小、数量及组成等方面上都有所不同[6]。
- 大小
核糖体的中轴线比直径稍长。 原核细胞中的70S核糖体直径约为20nm(200Å),相对分子质量约为2.5MDa[7];真核细胞细胞质基质中的80S核糖体直径则介于25nm至30nm之间(250-300Å),相对分子质量为3.9-4.5MDa,比70S核糖体大40%[8],真核细胞线粒体内的线粒体核糖体也比70S核糖体稍大一些[9]。
- 数量
核糖体是原核细胞中唯一的一种细胞器,每个原核细胞中一般含有约15-18×103个核糖体;每个真核细胞中一般有106至107个核糖体。蛋白质合成旺盛的细胞(如未成熟的蟾蜍卵细胞)中核糖体往往比正常细胞多,其含量可达每个细胞约1012个[10]。哺乳动物的成熟红细胞不具有核糖体[11]。
- 组成
核糖体都由rRNA及RP构成,是rRNA与RP的复合物,属于核糖核蛋白(Ribonucleoprotein,简称“RNP”)。每个核糖体包含2-4条rRNA与60-90种RP[注 2]。70S核糖体中,rRNA约占65%,核糖体蛋白质约占35%;80S核糖体中,rRNA与RP之比接近1:1;而线粒体核糖体中蛋白质所占比例是最高的,在这类核糖体中,rRNA约占25%,核糖体蛋白质约占75%。由于核糖体的核心成分是RNA(而非DNA),核糖体被部分生物学家认为是“RNA世界”遗留至今的痕迹[12]。(参见本条目组成章节。)
- 结构

原核生物的核糖体与真核生物的核糖体十分相似[13],每个核糖体都由一大一小两个相互嵌合的-{zh-tw:次單元;zh-cn:亚基}-组成。根据改进自二位点模型(two-site model)的三位点模型(three-site model)[14],核糖体中含有A、P、E三个与tRNA结合的位点[15]。除以上三个tRNA位点之外,核糖体中还有结合mRNA及一些翻译因子的位点。(参见本条目结构章节)
- 功能
核糖体可以与mRNA结合,在多种翻译因子的辅助下读取其中的遗传信息,并按照特定的信息利用tRNA转运来的氨基酸合成具有特定一级结构的多肽。对该过程有重要作用的活性区域是由RNA构成的,所以核糖体也被归为核酶[16]。(核糖体执行其功能的详细过程参见本条目工作过程章节)
- 分类
- 单位
研究核糖体及相关物质时常用代表单位离心力场下的沉降速度的沉降系数(sedimentation coefficient)来描述[注 3]。沉降系数的一般表达式为[注 4][17]:
沉降系数以时间表示,一般使用斯维德伯格单位[注 5],符号为S。
历史事件
基础研究
核糖体是由罗马尼亚籍细胞生物学家乔治·埃米尔·帕拉德用电子显微镜于1955年在哺乳类与禽类动物细胞中首次发现直径20nm,富含RNA,能够制造酶,他将这种新细胞器描述为密集的微粒或颗粒[18]。一年之后,A. J. Hodge等人在多种植物的体细胞中也发现了核糖体,可是当时人们仍无法将微粒体中的核糖体完全区分开来[19]。后来,乔治·帕拉德以及阿尔伯特·克劳德和克里斯汀·德·迪夫因发现核糖体于1974年被授于诺贝尔生理学或医学奖。
虽然核糖体作为一种细胞器在20世纪50年代初期已被发现,但对这种细胞器仍没有统一的命名。直到1958年,科学家理查德·Template:Lang·罗伯茨(Template:Lang)才推荐人们使用“核糖体”一词:
从此,人们对几种细胞结构碎片概念上的理解逐渐清晰,核糖体这一细胞器本身也有了更明确的定义。这次统一命名为核糖体及相关方面的研究的发展奠定了良好的基础。
在进入20世纪60年代后,随着人们对核糖体的探索的不断深入,许多学术成果也不断涌现。苏联生物化学家亚历山大·谢尔盖维奇·斯皮林经过长期研究,发现核糖体各组分实际上不需其他物质辅助即可发生自我组装[20]。Warner JR等人在1963年发现众多核糖体共同翻译同一条mRNA的现象,并将他们发现的结构名命为“多核糖体”(polyribosome)[21]。而B. J. McCarthy和J. J. Holland则1965年发现被干扰的核糖体在无细胞系统中可直接利用DNA作为模板合成蛋白质,而新霉素等抗生素可增强这种特殊的翻译[22]。在对不同类型的核糖体的研究方面,汤姆·奥布赖恩等人作出了较大贡献:1967年,奥布赖恩等人在大鼠肝脏细胞的线粒体中发现核糖体[23]。1971年,奥布赖恩等证实之前在线粒体中发现的沉降系数约为55S的核糖体是与70S核糖体或80S核糖体都不相同的另一类核糖体[24]。同年,奥布赖恩等人又在牛胚胎的肝脏细胞线粒体内发现原本以为只存在于细胞质基质中的80S核糖体,并证实这些80S核糖体仍具有合成蛋白质的活性[25]。
20世纪末各种显微技术的发展使人们对微观事物的研究上了一个台阶。2000年,Poul Nissen等人测得核糖体大-{zh-tw:次單元;zh-cn:亚基}-中正在形成的肽键周围1.8nm范围内除了23S rRNA结构域Ⅴ的部分原子外,不存在任何核糖体蛋白质侧链原子,从而证明了核糖体是一种核酶[26]。
核糖体及翻译系统中的相关分子(例如一种被称为翻译装置(translational apparatus)的分子)的结构及功能是20世纪中期研究的热点。直到今天,该领域的研究仍十分活跃。
精细结构研究
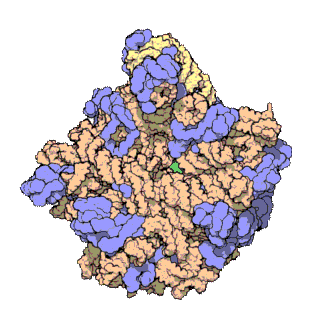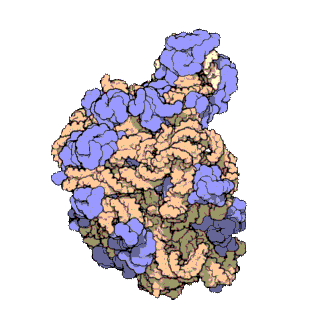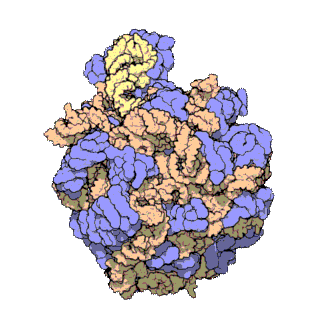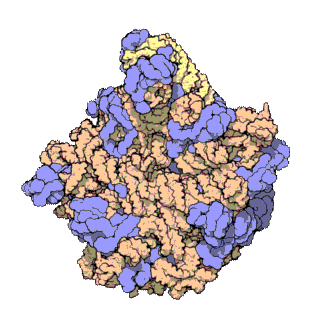
早在20世纪70年代初期,人们已开始着手了解核糖体整体的分子结构。
2000年,最初几份关于核糖体原子级结构的论文连续发表:最先公布的是属于古菌中的死海盐盒菌(Haloarcula marismortui)核糖体50S-{zh-tw:次單元;zh-cn:亚基}-的结构图[27]和属于细菌中的抗輻射奇異球菌(Deinococcus radiodurans)[28]。不久之后,属于Template:Link-en(Thermus thermophilus)核糖体30S-{zh-tw:次單元;zh-cn:亚基}-的结构图也被公布[29]。紧接着,又有一份更精细的结构图被公布[30]。九年后,文卡特拉曼·拉马克里希南、托马斯·施泰茨和阿达·约纳特因为确定这些核糖体的详细结构和机制而被授予2009年诺贝尔化学奖[31]。2001年5月,上述几份结构坐标被用于重现精确到5.5Å的嗜热栖热菌完整的70S核糖体分子结构[32]。

两份关于大肠杆菌(Escherichia coli)的70S核糖体结构的论文则于2005年被发表。论文中描述了使用X射线晶体学方面的技术获得分辨率高达3.5Å的中空核糖体(未结合mRNA或tRNA的核糖体)的结构[33]。在该篇论文发表两周后,一份基于冷电子显微镜技术的结构图被公布[34],该图以11-15Å的分辨率描绘了核糖体中一条刚合成的肽链被输入蛋白质输出通道(protein-conducting channel)的画面。一年之后,结合了mRNA和tRNA的核糖体的原子级结构图由两个研究小组分别以2.8Å的分辨率[35]及3.7Å的分辨率[36]独立绘出。这些结构图使人们最终看到嗜热栖热菌核糖体与在该核糖体经典区域中结合的mRNA、tRNA一起反应的细节。过了不久,核糖体与一些含有夏因-达尔加诺序列的长链mRNA的反应也被在4.5-5.5Å的分辨率下可视化[37]。
在2011年,第一个从酵母中的酿酒酵母菌(Template:Lang)的真核生物80S核糖体的完整的原子结构由晶体衍射获得。[38]该模型揭示了真核生物特有要素的结构以及它们与普遍保存内核的相互作用。
合成
核糖体自组装
Template:Main 在细菌细胞中,核糖体是通过对多个rDNA的操纵组的转录在细胞质中合成的[39]。 在真核细胞中,核糖体的合成主要发生在细胞核的核仁(细胞核中的一个区域)里。在该区域中,rDNA转录产生的45S rRNA前体(rRNA的前体分子)与从细胞质中运来的蛋白质结合形成80S rRNP前体,80S rRNP前体再经过加工(其中的45S rRNA前体被RNA酶裂解成5.8S rRNA、18S rRNA及28Sr RNA的较小的rRNA片段),在5-10min内剪切成32S rRNP和20S rRNP。20S rRNP在5min内再经加工形成12S rRNP,率先装配成40S核糖体-{zh-tw:次單元;zh-cn:亚基}-。32S rRNP在经加工剪切为28S rRNP及5.8S rRNP后,需耗费约30min才能与在核仁外合成的5S rRNA(5S rDNA不定位在核仁组织区)共同装配成60S核糖体-{zh-tw:次單元;zh-cn:亚基}-。[40]大小-{zh-tw:次單元;zh-cn:亚基}-经核孔排入细胞质后,装配成核糖体。
核糖体一般的合成过程需要超过200种蛋白质的协同配合来完成聚合、加工核糖体内的4个rRNA,以及将rRNA和多种核糖体蛋白捆绑、组装在一起。
大小-{zh-tw:次單元;zh-cn:亚基}-的聚合与解聚
大小-{zh-tw:次單元;zh-cn:亚基}-在细胞质中可分离存在,但两者嵌合成完整核糖体后才具备翻译能力[41]。
当Mg2+的浓度为10mmol/L时,大小-{zh-tw:次單元;zh-cn:亚基}-聚合;Mg2+的浓度降至0.1mmol/L时,大小-{zh-tw:次單元;zh-cn:亚基}-则会发生解聚[42]。
分布及分布状态
在真核细胞中,细胞质核糖体以其分布状态分为游离核糖体(free ribosome)与膜结合核糖体(membrane-bound ribosome)两类。同一种生物的-{游}-离核糖体与膜结合核糖体在结构上是没有区别的,它们的不同只在于两者在细胞中分布位置上的差异。
-{游}-离核糖体
约70%的细胞质核糖体处于-{游}-离状态[43],这些悬浮在细胞质基质中的核糖体称为“-{游}-离核糖体”。-{游}-离核糖体几乎可以在细胞质基质中沿细胞骨架任意移动。在-{游}-离核糖体上合成的蛋白质会直接释放到细胞质基质中,这些蛋白质只能用于构成该细胞自身结构(称为内源性蛋白,如肌红蛋白或肌纤维蛋白等)。
由于细胞质在整体上处于还原氛中且常含有高浓度的谷胱甘肽,所以具有二硫键的蛋白质(二硫键由半胱氨酸残基形成)不能在-{游}-离核糖体中合成。
状态转换
一个核糖体是处于-{游}-离态还是膜结合态仅仅取决于它们正在翻译的mRNA单链首端第一个三联体密码子(AUG)之后是否有一段“内质网靶向信号序列”(ER-targeting signal sequence,长度约为45-90nt),该序列经核糖体翻译,能得到长度约为16-26个氨基酸的多肽片段(称为“信号肽”,signal peptide),这种合成了信号肽的核糖体在肽链延伸约80个氨基酸残基后将进入膜结合态[注 6],附着在内质网上[44]。
核糖体翻译出的信号肽暴露在细胞质基质中,会被信号识别颗粒(Signal Recognition Particle,简称SRP)识别结合,SRP能以其类似tRNA分子的构型占据核糖体的A位点,使核糖体翻译暂时停止。SPR可识别糙面内质网膜上相应的SRP受体(又称停泊蛋白,docking proteins),而SRP受体又能使核糖体通过它与内质网上的易位子(translocon)相连[注 7]。当核糖体停止浮动后,SRP便与其受体分离,但核糖体将仍粘附在内置网膜上开始继续翻译,延伸的肽链则穿过易位子中的通道进入糙面内质网腔[45]。
膜结合核糖体
聚核糖体
常见多个核糖体排列成螺纹状或念珠状,一起沿着一条mRNA单链进行翻译。这种由一个mRNA串起来的多个核糖体的结构被称为“聚核糖体”或“多聚核糖体”,它可以提高mRNA的翻译效率[46]。
组成
- 原核细胞拥有沉降系数为70S的70S核糖体,它由沉降系数为30S的小次單元的和沉降系数50S的大次單元组成。70S核糖体包含3种沉降系数不同的rRNA和大约55种RP,其中小-{zh-tw:次單元;zh-cn:亚基}-由16S rRNA(重约0.6MDa、长约1540nt[47])和21种RP构成,大-{zh-tw:次單元;zh-cn:亚基}-由5S rRNA(重约40kDa,长约120nt[48])、23S rRNA(重约1.2MDa,长约2900nt[49])和34种RP构成。[50][51]
- 真核细胞拥有沉降系数为80S的80S核糖体,它由沉降系数为40S的小次單元和沉降系数为60S的大次單元组成。80S核糖体包含4种沉降系数不同的rRNA及逾80种RP。其中,小-{zh-tw:次單元;zh-cn:亚基}-由18S rRNA(重约0.7MDa,长约1900nt)和约33种RP构成,而大-{zh-tw:次單元;zh-cn:亚基}-则由5S rRNA(性质与70S核糖体内的基本相同)、5.8S rRNA(重约40kDa,长约160nt)、28S rRNA(重约1.7MDa,长约4700nt)和约49种RP构成。[49][50][51]一些真核生物的线粒体或叶绿体中也包含有一大一小两个以蛋白质相连的-{zh-tw:次單元;zh-cn:亚基}-的70S核糖体。根据“内共生学说”,真核细胞中的线粒体及叶绿体都是由被其他细胞吞噬的细菌演化而来的,所以这两种细胞器中存在的核糖体与细菌细胞中的相似[52]。
- 粒線体核糖体(mitoribosome),或55S核糖体,由沉降系数为28S的小次單元和沉降系数为39S的大次單元组成[53]。线粒体核糖体中含有2-3种rRNA和60-80种RP,作为比较人类线粒体核糖体含有78种RP[54],其中小-{zh-tw:次單元;zh-cn:亚基}-中含有长度约为950nt的12S MT-RNR1,而大-{zh-tw:次單元;zh-cn:亚基}-中则含有长度约为1560nt的16S MT-RNR2[49]。Template:Fact。
相关组分
结构

核糖体都由一大一小两个-{zh-tw:次單元;zh-cn:亚基}-构成,这两个-{zh-tw:次單元;zh-cn:亚基}-中各具有为合成中的肽链、mRNA、tRNA及翻译因子等分子提供的特殊的结构。核糖体大-{zh-tw:次單元;zh-cn:亚基}-与小-{zh-tw:次單元;zh-cn:亚基}-之间存在称为“桥”的接触面,总共有12对桥将大、小-{zh-tw:次單元;zh-cn:亚基}-连接起来,它们还起到大、小-{zh-tw:次單元;zh-cn:亚基}-间传递信息的作用。70S核糖体的这些桥中,除了3对桥中包含了RP,其余的桥都由rRNA组成。rRNA桥主要由16S rRNA小沟与23S rRNA小沟之间的相互作用来建立。rRNA-RP桥则通过蛋白质识别RNA结构而实现[55]。
核糖体大-{zh-tw:次單元;zh-cn:亚基}-
核糖体大次單元外侧边缘有三个较明显的凸起,凸起之间有两处凹陷。大-{zh-tw:次單元;zh-cn:亚基}-内部有一条起源于肽酰转移酶中心附近,横贯大-{zh-tw:次單元;zh-cn:亚基}-的、为合成中的肽链提供的狭长通道(称为“肽链输出通道”),这条通道长约35aa[56](约8.5nm)。各种原核生物50S大-{zh-tw:次單元;zh-cn:亚基}-肽链输出通道的孔径大小并不完全相同(孔径最大约2nm,最小约1nm),主要由23S rRNA构成,同时需要一些RP(如L4、L22、L39等)辅助成形[55]。有研究认为该通道具有动态的结构,不仅能与新生肽链中的效应模体相互作用调节翻译效率,而且能够调节通过通道的多肽链的共翻译折叠及翻译后修饰[57]。
核糖体小-{zh-tw:次單元;zh-cn:亚基}-
核糖体小次單元大致呈扁弧形,一面也有凹陷。在小-{zh-tw:次單元;zh-cn:亚基}-一端约三分之一处有一条为mRNA穿过提供的凹槽(也称为小-{zh-tw:次單元;zh-cn:亚基}-的“颈部”),该凹槽处的空间局限使得mRNA的解码区呈现U形转角构象[55]。
核糖体位点
- 核糖体A位点(amino acyl-tRNA site,简称“A位”),也称“受位”,是核糖体内接受新氨酰-tRNA的位点,主要部分位于大-{zh-tw:次單元;zh-cn:亚基}-中。在A位处5S rRNA有一段序列能与氨酰-tRNA的T29C环的保守序列互补,便于新氨酰-tRNA移入A位。起始用的tRNA没有该段序列,故它只能直接进入核糖体P位。[56]
- 核糖体P位点(peptidyl-tRNA site,简称“P位”),也称“供位”,是核糖体内前一个tRNA将其肽基或甲酰甲硫氨酰基转移至后一个tRNA上的位点。该位点在大-{zh-tw:次單元;zh-cn:亚基}-中的区域含有肽酰转移酶。在对核糖体结晶学的研究中人们发现,核糖体该位点内的肽酰转移酶附近1.8nm的范围内并没有核糖体蛋白质[58](一般认为细胞中的主要催化剂的化学本质是蛋白质)。该发现表明,核糖体中的蛋白质组份本身可能并不直接作为催化剂,而是充当rRNA依附的架构,并起到增强rRNA催化能力的作用(参见:核酶)。
工作过程

Template:Seealso 原核细胞与真核细胞中进行的翻译过程并不完全相同,大致可分为被原核翻译、真核翻译与古菌翻译[59]三种类型。这三种类型翻译步骤基本相同,但这几种翻译中利用的核糖体、mRNA及tRNA等在结构上有一定差异,且各需要一套翻译因子系统的参与(其中真核翻译中涉及的生物大分子约有200种[60])。
由核糖体主导的翻译主要可分为起始、延伸、终止及再循环4个步骤[61]。
核糖体对mRNA的翻译过程是迅速且准确的。在37℃时,细菌细胞内合成肽链的速度约为每秒连接15个氨基酸[3]。当其合成速度达到每秒连接1000个氨基酸时,错误率约为十万分之一[62]。
翻译起始
原核翻译与翻译中的起始过程基本相同:都先由fmet-tRNA、待翻译mRNA和核糖体组成翻译起始复合物(translation initiation complex)[63]。翻译的起始过程需要起始因子参与,已发现的原核起始因子有3种,古菌起始因子有4种,真核起始因子有12种。
- 在原核翻译中,待翻译mRNA5'端上游的夏因-达尔加诺序列(S-D序列)可通与核糖体小-{zh-tw:次單元;zh-cn:亚基}-16S rRNA3'端的反夏因-达尔加诺序列的互补而结合[64]。紧接S-D序列的短核苷酸序列可被小-{zh-tw:次單元;zh-cn:亚基}-核糖体蛋白识别结合,mRNA在这两方面作用下小-{zh-tw:次單元;zh-cn:亚基}-上定位。在mRNA与小-{zh-tw:次單元;zh-cn:亚基}-结合后,fMet-tRNAfMet结合于mRNA-小-{zh-tw:次單元;zh-cn:亚基}-复合体的起始密码子上,形成30S翻译起始复合物,大-{zh-tw:次單元;zh-cn:亚基}-再与该复合体结合,形成70S翻译起始复合物[65]。左图是原核翻译起始过程的图解。
- 在真核翻译中,已发现的起始方式有4种:帽依赖性起始(cap-dependent initiation)、重新起始(reinitiation)、核糖体支路(ribosome shunting)及内部起始(interal initiation)[66],其中,帽依赖性起始为主要的起始方式。在帽依赖性起始中,mRNA5'端帽上结合的帽结合蛋白(cap-binding protein,CBP)异源二聚体能促进mRNA分子在核糖体上的定位[67],在这个过程中,如果检测到mRNA上提前出现无义终止密码子,无义介导的mRNA降解机制(nonsense-mediated mRNA decay,NMD)便会将错误的mRNA降解[68]。在真核翻译起始过程中,mRNA依靠科扎克共有序列与核糖体小-{zh-tw:次單元;zh-cn:亚基}-识别结合[69][70]。
肽链延伸
翻译起始后,核糖体沿mRNA链由5'端朝3'端移动。从起始密码子处开始,核糖体利用具有与当前正在翻译的密码子相对应的反密码子的氨酰-tRNA携带的氨基酸合成肽链。核糖体每翻译一个三联体密码子就为延伸中的肽链的C端添加一分子氨基酸,其自身也同时顺着mRNA单股移动一段距离。
肽链延伸阶段是一个不断循环进行的过程(直至核糖体到达终止密码子处)。该阶段可再细分为进位、成肽和移位三个步骤。真核及原核翻译延伸阶段的不同主要在于各自延伸因子体系的不同:已发现的原核延伸因子有3种,古菌延伸因子有2种,真核延伸因子有2种[71]。

进位
根据核糖体A位内mRNA部分密码子的引导,具有对应反密码子的氨基酰-tRNA进入A位的步骤,称为“进位”。
- 原核翻译中,结合了GTP的延伸因子EF-Tu(EF-Tu·GTP)与氨基酰-tRNA形成氨基酰-tRNA·EF-Tu·GTP三元复合物并进入核糖体A位。EF-Ts催化水解复合物携带的GTP产生能量完成进位。之后,EF-Tu·GDP脱离核糖体,EF-Tu则释放出GDP并与EF-Ts重新复合形成EF-T,以待再次被利用。
- 真核翻译中,氨基酰-tRNA由eEF-1以复合成氨基酰-tRNA·eEF-1·GTP三元复合物的形式带入核糖体的A位[72]。GTP水解后,eEF-1·GDP离开核糖体。在真菌细胞中,延伸步骤还需要第三种真核延伸因子(eEF-3)参加,其作用是维持翻译的准确性[71]。

转肽
核糖体的肽酰转移酶催化位于核糖体P位的tRNA上运载的甲酰甲硫氨酰基或肽酰基转移到A位内刚进入核糖体的新氨基酰-tRNA转运的氨基酸上,使前者的羧基与后者的氨基之间脱水缩合形成肽键。此步骤称为“转肽”(transpeptidation)。
转肽步骤完全由核糖体大-{zh-tw:次單元;zh-cn:亚基}-内的核酶催化完成[73]。在转肽这一步骤中生成的肽酰-tRNA将占据核糖体A位,而P位中刚卸载甲酰甲硫氨酰基或肽酰基的空载tRNA则将进入核糖体的E位。

移位
EF-G将位于核糖体A位的tRNA推入P位的步骤称为“移位”。
EF-G具有转位酶活性,能催化GTP水解提供能量,推动处于核糖体A位的肽酰-tRNA[74],使之进入P位(同时使P位中的tRNA进入E位、并使E位的tRNA排出核糖体),核糖体也沿mRNA移动一个密码子。核糖体移位后,其A位将再次空出,为新氨基酰-tRNA进位提供空间。
在肽链延伸的过程中,上述三个步骤是重复循环的。循环每完成一次,肽链的C端便加入一个氨基酸分子,直至翻译进入终止阶段。
翻译终止

在核糖体读取至终止密码子[注 8]时,翻译进入终止阶段。翻译的终止需要释放因子的参与[75]。已发现的原核释放因子有3种,而真核释放因子有2种[76][注 9]。
- 原核翻译中,终止密码子由Ⅰ类释放因子能识别[77]。其中,RF-1能识别终止密码子UAA、UAG;而RF-2能识别UAA、UGA[78]。Template:Fact。
联读翻译
Template:Main 翻译终止失败可能导致核糖体越过终止密码子,朝mRNA的3'端继续翻译,这种现象称为“联读翻译”(read-through translation)。已发现多种mRNA联读翻译的产物达到可检测的水平。许多具有重要生理意义的蛋白质就是通过这种方式合成的。[81]
核糖体再循环
核糖体再循环是核糖体参与的翻译中的最后一个过程。在该过程中,核糖体复合物发生解体,以便投入下一次使用。该过程是在核糖体再循环因子(RRF)和参与蛋白质合成过程中转位的延伸因子(EF-G)的协同作用下完成的。核糖体在其再循环过程中由RRF的结构域Ⅰ识别结合核糖体的功能。RRF的结构域Ⅱ则具有将核糖体解离为大、小次單元的能力。[82]
功能抑制
化学药剂师如今已可以利用细菌与真核生物(如人类)细胞中核糖体结构的差异来提取或合成能抵抗细菌感染而不损伤受感染者自身细胞的抗生素(如氨基糖苷类抗生素、四环素类抗生素等蛋白质合成抑制剂类抗生素),这类抗生素能抑制感染患者的病原体微生物的细胞内的蛋白质合成。基于70S核糖体与80S核糖体结构上的不同,细菌细胞中的70S核糖体较容易受到某些抗生素的损害而真核细胞中的80S核糖体却可以不受影响[83]。虽然一些真核生物的线粒体中也含有类似细菌核糖体的70S核糖体,但线粒体拥有具有一定选择透过性、使这些抗生素不能随意透过的双层磷脂双分子膜,所以这些细胞器也可以避免该类抗生素对其中核糖体的影响[84]。
参见
注释
- ↑ 因为在某些场合“细胞器”一词也会被用于专指具有磷脂双分子层膜结构的亚细胞结构,而核糖体虽然已是一种公认的细胞器,却是没有被膜包裹、完全裸露的大分子,所以核糖体有时会被严格地定义为“无膜细胞器”(non-membranous organelles)。
- ↑ 70S核糖体、80S核糖体或线粒体核糖体各自拥有的rRNA与RP的数量是相对固定的,但三者组分之间的数量差异较大。文中给出的范围是指不同类核糖体所含rRNA与RP的数量的范围,而不是某单独一类核糖体各组分的范围。参见本条目组成一节。
- ↑ 需注意的是,沉降系数代表的并不是物质的大小或数量,所以核糖体各组分名称中的数字相加并不等于原核糖体名称中的数字。例如,70S核糖体实际上由30S核糖体-{zh-tw:次單元;zh-cn:亚基}-及50S核糖体-{zh-tw:次單元;zh-cn:亚基}-组成,而30+50≠70。
- ↑ 其中,ω代表离心转子的角速度(单位为rad/s),r代表物质到旋转中心的距离(单位为m),代表沉降速度(单位为m/s)。
- ↑ 蛋白质、核酸及核糖核蛋白等生物大分子的沉降系数往往在10-13s左右,为方便起见,沉降系数中10-13s可换算为一个斯维德伯格单位,量纲为秒。
- ↑ 翻译时未在mRNA上读取到上述信号序列的核糖体则仍将保持游离状态。核糖体转变为膜结合态只是为了合成能导入内质网腔并分泌到细胞外的蛋白质,合成非分泌蛋白的-{游}-离态核糖体不需要转换至膜结合态。
- ↑ 易位子是一种蛋白质偶联通道,糙面内质网膜中存在能与SRP受体结合的易位子,故核糖体可以粘附在糙面内质网上。
- ↑ 终止密码子有三种,分别为UAA(赭石密码子)、UAG(琥珀密码子)和UGA(蛋白石密码子)。三种终止密码子都不对应任何氨基酰-tRNA,所以不能被任何氨基酰-tRNA识别。
- ↑ 原核释放因子分为RF、RR两类,其中RF可再细分为RF1与RF2(Ⅰ类)及RF3(Ⅱ类)。真核释放因子仅有RF,也可细分为两类:eRF1(Ⅰ类)与eRF3(Ⅱ类)。
参考文献
外部链接
- 70S核糖体翻译动态演示. 需要安装此处的插件观看(需要注册)
- 实验室计算机模拟运动中的核糖体
- 核糖体在细胞中扮演的角色,Gwen V. Childs,复制于此
- 蛋白百科(Proteopedia) Template:Wayback中的Ribosome Template:Wayback——关于蛋白质及其他分子的自由的、合作性的3D百科全书
- ExPASy上的核糖体蛋白质家族 Template:Wayback
- 本月分子 Template:Wayback © RCSB 蛋白质数据库:
Template:- Template:细胞结构 Template:核糖体亚基
- ↑ Template:Cite book
- ↑ Template:Cite journal
- ↑ 3.0 3.1 Template:Cite book
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite book
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite book
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ 27.0 27.1 Template:Cite journal
- ↑ 28.0 28.1 Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ 2009年诺贝尔化学奖 Template:Wayback,诺贝尔基金会。
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite book
- ↑ Template:Cite book
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite book
- ↑ Template:Cite journal
- ↑ Template:Cite book
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ 49.0 49.1 49.2 Template:Cite web
- ↑ 50.0 50.1 Template:Cite web
- ↑ 51.0 51.1 Template:Cite book
- ↑ Template:Cite book
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ 55.0 55.1 55.2 Template:Cite web
- ↑ 56.0 56.1 Template:Cite book
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ 71.0 71.1 Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite book
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal