二氧化硅
Template:Refimprove Template:Expert Template:NoteTA Template:Redirect2 Template:Chembox
二氧化矽(化学式:Template:Chem)是一种酸性氧化物,对应水化物为偏矽酸(Template:Chem)。它自古便為人所知。 二氧化矽在自然界中最常见于石英、以及各种生物体中[1][2]。在世界的许多地方,二氧化矽是砂的主要成分。二氧化矽是最复杂和最丰富的材料家族之一,既是多种矿物质,又是被合成生产的。值得注意的实例包括熔融石英,水晶,热解法二氧化矽,矽胶和气凝胶。 应用范围从结构材料到微电子学到食品工业中使用的成分。
二氧化矽是矽最重要的化合物,约占地壳质量的12%。自然界中二氧化矽的存在形态有结晶形和无定形两大类,因此统称為矽石。
结构

Template:Chem晶体有多种晶型,其基本结构单元是四面体,每个Si周围结合4个O,Si在中心,O在四个顶角;最小环上有6个硅原子和六个氧原子。许多这样的四面体又通过顶角的O相连接,每个O为两个四面体所共有,即每个O与2个Si相结合。实际上,Template:Chem晶体是由Si和O按1:2的比例所组成的立体网状结构的晶体。因此,通常用Template:Chem来表示二氧化硅的组成。Template:Chem四面体不仅存在于Template:Chem晶体中,而且存在于所有硅酸盐矿石中,是构成多姿多彩的硅酸盐世界的基本骨架。
物理性质
硬度大、耐高温、耐震、绝缘,可以透过可见光以及红、紫外线。Template:Citation needed
化学性质
二氧化硅是酸性氧化物,对应的最高价水化物为硅酸(Template:Chem)。 二氧化硅化学性质不活泼,不容易与水和大部分酸发生反应。通常只能与碱性氧化物反应生成盐。氢氟酸(Template:Chem)和浓热的磷酸(Template:Chem)是可以与之反應的酸。
其与氫氟酸反应生成氟化矽的化学方程式为:
与强碱反应生成盐。例如:
空氣中若存在一定濃度的二氧化矽粉粒時,會經人類呼吸進入肺部,引發呼吸器官的相關疾病,例如塵肺症。

用途

Template:Chem的网状结构决定了它具有优良的物理和化学性质,加上Template:Chem在自然界的广泛存在,从古到今都被人类广泛地应用着。 二氧化硅与其它化合物在高温下熔融,快速冷却可以制得玻璃。它也是沙子和石英的主要成分。在半導體和太陽能板等應用中,是目前主要的原料。
僅含二氧化矽單一成分的特種玻璃叫做石英玻璃。二氧化矽與石墨或活泼金属混合可以发生氧化还原反应制得硅单质。
Template:Chem於食品工業用作抗結劑,屬食品添加劑之列。胶态,沉淀或热解法气相二氧化硅是食品生产中的常见添加剂。 它主要用作粉状食品(例如香料和非乳制咖啡奶精)中的流动剂或防结块剂,或制成片剂的粉剂。它可以在吸湿性应用中吸收水。 胶态二氧化硅用作葡萄酒,啤酒和果汁的澄清剂,E编号为E551。
在化妆品中,二氧化硅因其光扩散特性[30]和自然吸收性而有用。
硅藻土(一种开采的产品)二氧化硅在食品和化妆品中使用了几个世纪。 它由微观硅藻的硅石壳组成。 它以较少加工的形式作为“牙粉”出售。制造或开采的水合二氧化硅用作牙膏中的硬质磨料。 二氧化硅还可用作催化剂载体,典型用途是制备硫化氢选择性氧化为硫磺的催化剂。
健康影响
经口摄取的二氧化硅基本上是无毒的,Template:LD50为5000mg / kg,因此完全可以用于食品。然而,吸入细分散的结晶二氧化硅粉尘可能导致矽肺病,支气管炎或癌症,因为灰尘停留在肺中并持续刺激组织,从而降低肺容量[3]。研究显示,暴露于结晶二氧化硅的工人比一般人群的狼疮和其他自體免疫性疾病的预期高出10倍[4]。美國在2013年发布新规范之前,Template:Le(OSHA)允许每立方米空气含100μg二氧化矽,而新规定将含量减少至50μg/m3。建筑业的暴露限值也设定为从250 µg/m3下降至50 µg/m3。
结晶形式
SiO2,以比几乎任何材料都多的许多晶体形式(称为多晶型物)存在。
| 形式 | 晶体对称性 皮尔逊符号, 组号 |
ρ g/cm3 |
注释 | 结构 |
|---|---|---|---|---|
| α-石英 | 六方晶系 (三角形) hP9, P3221 No.154[5] |
2.648 | 使单个单晶具有光学活性的螺旋链; α-石英在846K下转化为β-石英 | 
|
| β-石英 | 六方晶系 hP18, P6222, No. 180[6] |
2.533 | 与α-石英密切相关(具有155°的Si-O-Si角)和光学活性; β-石英在1140K转化为β-鳞石英 | 
|
| α-鳞石英 | 正交晶系 oS24, C2221, No.20[7] |
2.265 | 正常压力下的稳定形式 | 
|
| β-鳞石英 | 六方晶系 hP12, P63/mmc, No. 194[7] |
与α-鳞石英密切相关; β-鳞石英在2010 K时转化为β-方石英 | 
| |
| α-方石英 | 四方晶系 tP12, P41212, No. 92[8] |
2.334 | 正常压力下的稳定形式 | 
|
| β-方石英 | 立方晶系 cF104, Fd3m, No.227[9] |
与α-方石英密切相关; 在1978 K熔化 | 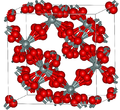
| |
| Template:Le | 四方形 tP36, P41212, No. 92[10] |
3.011 | Si5O10, Si4O14, Si8O16 环; 由玻璃状二氧化硅和碱在600-900K和40-400MPa下合成 | 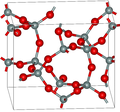
|
| Template:Le | 单斜晶系 mS46, C2/c, No.15[11] |
Si4O8和Si6O12 环 | 
| |
| 柯石英 | 单斜晶系 mS48, C2/c, No.15[12] |
2.911 | Si4O8和Si8O16环; 900 K 和 3–3.5 GPa | 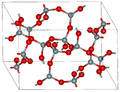
|
| 斯石英 | 四方形 tP6, P42/mnm, No.136[13] |
4.287 | 二氧化硅的最密集的(同时是赛石英)多晶型; 金红石型与6倍配位的硅; 7.5-8.5GPa | 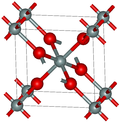
|
| Template:Le | 斜方晶 oP, Pbcn[14] |
4.294 | 二氧化硅的最密集的(同时是赛石英)多晶型; 它在高于40GPa的压力下产生。[15] | 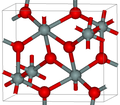
|
| Template:Le | 立方晶系 (cP*, P4232, No.208)[16] 或四方形 (P42/nbc)[17] | 2.04 | Si5O10, Si6O12环; 矿物总是被发现在间质空间中碳氢化合物 - 笼形硅[18] | 
|
| 纤维W-石英 | 斜方晶 oI12, Ibam, No.72[19] |
1.97 | Like SiS2 consisting of edge sharing chains, melts at ~1700 K | 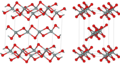
|
| Template:Le[20] | 六方晶系 | 片状双层结构 | 
|
参见
参考文献
Template:硅化合物 Template:氧化物 Template:二氧化硅矿物
- ↑ Template:Cite book
- ↑ Template:Cite journal
- ↑ CPWR-Center for Construction Research and Training — Work Safely with Silica: "What are the Health Effects? Template:Wayback
- ↑ The Future Directions of Lupus Research Template:Wayback. niams.nih.gov
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ 7.0 7.1 Template:Cite journal
- ↑ Template:Cite journal Template:Wayback
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal
- ↑ Template:Cite journal Template:Wayback
- ↑ Template:Cite journal Template:Wayback
- ↑ Template:Cite journal Template:Wayback
- ↑ Seifertite Template:Wayback. Mindat.org.
- ↑ Template:Cite journal Template:Wayback
- ↑ Template:Cite journal Template:Wayback
- ↑ Template:Cite book
- ↑ Template:Cite journal
- ↑ Template:Cite journal